当机体出现损伤、感染或异常细胞时,免疫大军中总有一类细胞率先抵达“现场”。它们不仅承担着“清道夫”的职责,吞噬清除异物与残骸,更扮演着“指挥官”与“工程师”的角色,通过释放信号分子塑造免疫微环境,协调修复与防御。这便是巨噬细胞——先天免疫系统中的核心成员与多功能特工。然而,在肿瘤这场“持久战”中,巨噬细胞却可能被敌方“策反”,从守护者转变为帮凶。深入理解其双重特性,正成为开发新型癌症免疫疗法的关键突破口。
巨噬细胞是谁?——先天免疫的“常备军”与“多面手”
在发育过程中,巨噬细胞存在多种不同的起源。组织器官中驻留的巨噬细胞(如胚胎期已定植的库普弗细胞、小胶质细胞等)来源于卵黄囊或胎肝造血;而出生后骨髓中的造血干细胞可分化为单核细胞,经血液循环迁移至组织,进一步分化为巨噬细胞,这些细胞主要参与免疫监视、炎症反应及组织修复等过程,并可在某些条件下补充或替换部分常驻巨噬细胞[1],它们是机体防御的第一道防线,也是维持组织稳态的重要调节者。
巨噬细胞功能极其多样,具备强大的吞噬能力,可清除凋亡细胞、病原体及细胞碎片。更重要的是,它们具有高度的可塑性,能根据微环境信号极化为不同的功能表型,其中最为经典的划分是M1型和M2型[2]。
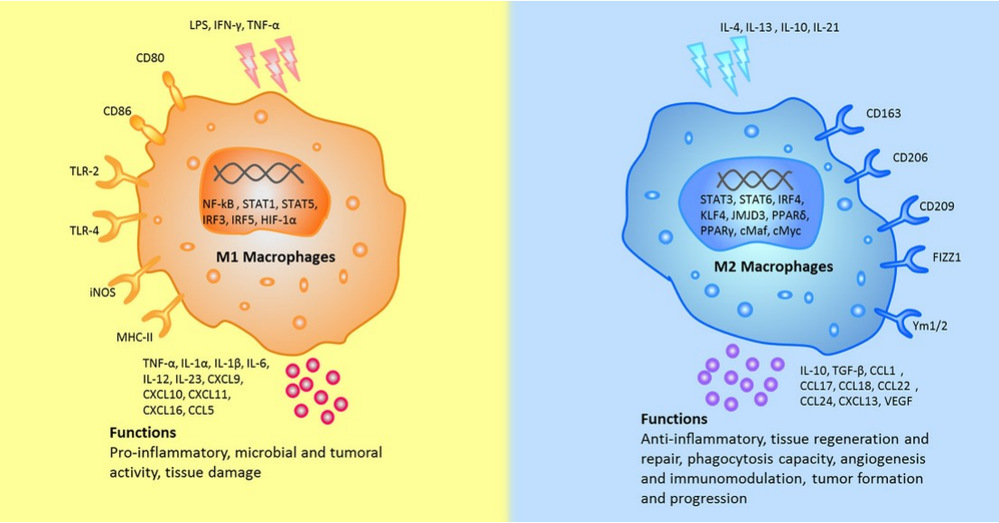
巨噬细胞在肿瘤中的“双面角色”
在肿瘤发生早期,巨噬细胞通常呈现M1型极化状态。这些“正义之师”通过分泌肿瘤坏死因子-α(TNF-α)、白细胞介素-12(IL-12)等促炎因子,激活其他免疫细胞,直接杀伤肿瘤细胞。它们还能通过抗原呈递作用,激活T细胞,启动特异性免疫应答,形成强大的抗肿瘤免疫反应。
然而,随着肿瘤进展,肿瘤细胞会分泌多种细胞因子,如集落刺激因子-1(CSF-1)、转化生长因子-β(TGF-β)等,将巨噬细胞“策反”为M2型。这些被“策反”的巨噬细胞,即肿瘤相关巨噬细胞(TAMs),转而支持肿瘤生长。M2型巨噬细胞通过分泌血管内皮生长因子(VEGF)、血小板衍生生长因子(PDGF)等,促进肿瘤血管新生,为肿瘤提供营养和氧气。它们还能分泌基质金属蛋白酶(MMPs),降解细胞外基质,为肿瘤侵袭和转移“开路”。更令人担忧的是,M2型巨噬细胞还能抑制T细胞功能,帮助肿瘤逃避免疫监视[3]。
巨噬细胞在肿瘤治疗中的应用前景
1.靶向TAMs的治疗策略
鉴于TAMs在肿瘤进展中的关键作用,靶向TAMs已成为肿瘤治疗的新方向。目前主要有以下几种策略:(1)抑制TAMs招募:阻断CSF-1/CSF-1R信号通路,阻断单核细胞向肿瘤组织的募集。CSF-1R抑制剂如pexidartinib已在临床试验中显示出抗肿瘤活性。阻断CCL2/CCR2信号通路与CXCL12/CXR4通路的效果也在进一步评估中。(2)重编程TAMs:通过CD40激动剂、Toll样受体激动剂等,将M2型巨噬细胞重编程为M1型,恢复其抗肿瘤功能。CD40激动剂如selicrelumab在胰腺癌等难治性肿瘤中显示出治疗潜力。(3)清除TAMs:使用双特异性抗体或抗体-药物偶联物(ADC)靶向TAMs表面标志物,如CD206、CD163等,选择性清除TAMs。
由于肿瘤免疫微环境的复杂性,单一靶向TAMs可能效果有限。因此,联合治疗策略成为研究热点。例如,TAMs靶向治疗联合免疫检查点抑制剂(如PD-1/PD-L1抑制剂),可以解除TAMs对T细胞的抑制,增强抗肿瘤免疫反应。此外,TAMs靶向治疗联合化疗、放疗等传统治疗手段,也能产生协同抗肿瘤效应[4]。
2.巨噬细胞免疫疗法
基于巨噬细胞的细胞免疫疗法已成为研究热点,其主要策略包括:(1)利用巨噬细胞的固有功能,如在体外进行培养扩增后回输。(2)将巨噬细胞开发为药物递送载体,用于输送小分子、核酸等治疗物质[5]。(3)通过基因工程手段增强其靶向性。例如,构建表达嵌合抗原受体(CAR-M)的巨噬细胞,使其能够特异性识别并杀伤肿瘤细胞,CAR-M疗法在卵巢癌、乳腺癌等实体瘤的临床前研究中已显示出显著效果[6]。
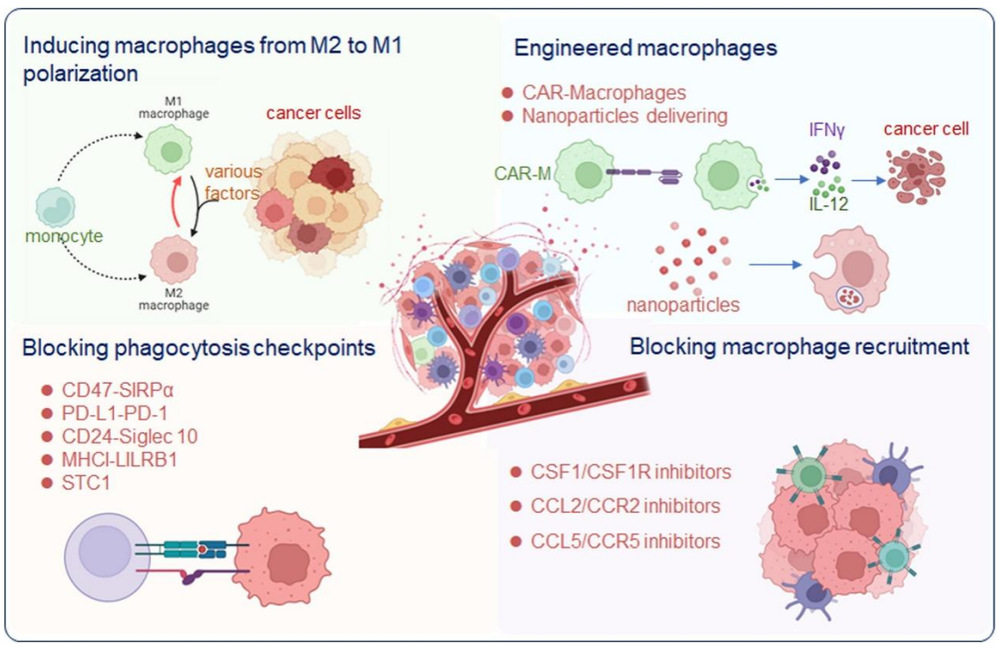
图2:针对巨噬细胞的治疗方法[7]
巨噬细胞,这只免疫系统的“常备多面手”在肿瘤微环境中不幸被“策反”,成为了疾病进展的重要推手。然而,也正是其复杂的可塑性和关键作用,使其成为癌症治疗中极具吸引力的靶点。从基础研究深入解析其调控网络,到临床转化中探索精准的靶向策略,围绕巨噬细胞的攻防战方兴未艾。未来,我们有望将这把“双刃剑”重新化为对抗肿瘤的利器,为癌症免疫治疗开辟全新的战场。
参考文献
[1] Wynn T A, Chawla A, Pollard J W. Origins and hallmarks of macrophages: development, homeostasis, and disease[J]. Nature, 2013, 496(7446): 445~455.
[2] Yao Y, Xu X-H, Jin L. Macrophage polarization in physiological and pathological pregnancy[J]. Frontiers in Immunology, 2019, 10: 792.
[3] Shapouri-Moghaddam A, Mohammadian S, Vazini H, Taghadosi M, Esmaeili S-A, Mardani F, Seifi B, Mohammadi A, Afshari J T, Sahebkar A. Macrophage plasticity, polarization, and function in health and disease[J]. Journal of Cellular Physiology, 2018, 233(9): 6425~6440.
[4] Li A-Q, Huang F, Talaiti S, Yang X, Bi H, Fang J-H. Understanding the complexity of tumor-associated macrophages: druggable and therapeutic insights[J]. Acta Pharmaceutica Sinica. B, 2025, 15(9): 4456~4475.
[5] Guan F, Wang R, Yi Z, Luo P, Liu W, Xie Y, Liu Z, Xia Z, Zhang H, Cheng Q. Tissue macrophages: origin, heterogenity, biological functions, diseases and therapeutic targets[J]. Signal Transduction and Targeted Therapy, 2025, 10(1): 93.
[6] Mantovani A, Allavena P, Marchesi F, Garlanda C. Macrophages as tools and targets in cancer therapy[J]. Nature Reviews. Drug Discovery, 2022, 21(11): 799~820.
[7] Liu Y, Tan H, Dai J, Lin J, Zhao K, Hu H, Zhong C. Targeting macrophages in cancer immunotherapy: frontiers and challenges[J]. Journal of Advanced Research, 2025, 76: 695~713.
