茫茫人海中,总有一些“特立独行”的个体:明明感染了严重的病毒,却不发病,甚至体内几乎检测不到病毒的踪迹。科学家把这些人称为“疾病的控制者”。他们就像免疫系统里的“顶级玩家”,用真实案例给我们展示:人类的免疫系统在理想状态下,原来可以很强大。这篇文章,我们重点聊一聊其中最经典的一类——HIV 的精英控制者(elite controllers),以及这些人背后隐藏的遗传密码和分子机制。
一、什么是“疾病控制者”?
在所有 HIV 感染者中,大约不到 1% 的人,即使从不使用抗病毒药物,血液中的病毒载量也持续低于临床检测下限(例如 <50 拷贝/mL),CD4 T 细胞计数长期保持正常,不发展为艾滋病,这类人被称为 HIV 精英控制者[1]。更重要的是,多数精英控制者并不是感染了有缺陷的病毒。许多研究表明,他们体内的 HIV 仍然是复制能力完好的病毒,只是被宿主的免疫系统牢牢按在地板上[2]。这意味着:关键在于人,而不在于病毒。换句话说,是宿主自身的免疫系统与遗传背景,造就了这种“奇迹般的控制能力”。在新冠(SARS-CoV-2)疫情期间,大家也常听到一个群体,无症状感染者。他们核酸阳性、体内有病毒复制,却几乎没有临床症状,甚至自己都不知道感染过。可能通过预先存在的交叉反应的免疫应答,使病毒在早期就被迅速控制,从而“不闹事”。类似的“控制者”还可能存在于其他疾病中,例如:某些乙肝患者能自发清除 HBsAg;部分人感染流感仅出现极轻的症状却迅速恢复。但在所有这些例子中,HIV 精英控制者是研究最深入、机制最为清晰的一类,因此成为理解“疾病控制者”现象的经典模型。
二、精英控制者背后的遗传基础
要解释为什么有的人可以控制 HIV,就绕不开一个关键基因区域:人类白细胞抗原(HLA)基因簇,该基因簇位于人类第6号染色体上 (图1)。全基因组关联研究(GWAS)反复提示:在所有与 HIV 病程进展相关的遗传因素中,HLA I 类基因,特别是 HLA-B 位点,贡献最大。某些等位基因,如HLA-B57、HLA-B27,与 HIV 精英控制者高度相关,能显著延缓病程、降低病毒载量。相反,一些等位基因(如 HLA-B*35 某些亚型)则与疾病进展加快、病毒载量更高相关[3]。简单理解:不同的 HLA,就像不同“版本”的抗病毒指挥官,有的战术高明,有的则容易被病毒“玩弄”。HLA I 类分子最核心的功能,是在几乎所有有核细胞表面呈递来源于病毒的短肽,让 CD8+ T 细胞通过 TCR 检查这些“肽–HLA 复合体”,从而识别并杀伤被感染的细胞。在精英控制者中,“有利”的 HLA 具有一些共同特征:更倾向于呈递 HIV 的保守区域(如 Gag 蛋白中的某些关键表位),病毒一旦对这些位点产生逃逸突变,就会严重损害自身复制能力;所呈递的表位能够诱导出高效能的 CD8+ T 细胞:交叉识别能力强;增殖能力强;多功能(同时分泌 IFN-γ、TNF-α等多种效应分子);这些表位往往位于病毒结构或复制周期中不易“动”的关键节点,病毒付出巨大代价才能“躲过”识别[4]。因此,拥有特定 HLA 组合的个体,面对 HIV 时能发起一场极为高效、持久且针对要害的免疫围剿,这为他们成为“精英控制者”奠定了遗传基础。
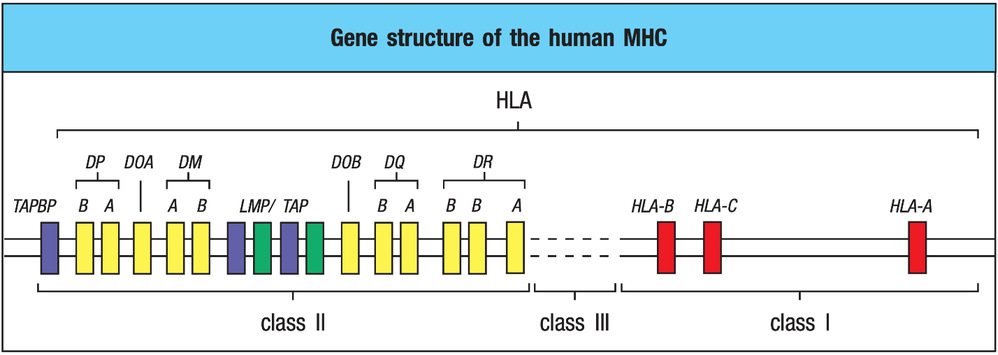
图 1. 人类白细胞抗原(human leukocyte antigen,HLA)的遗传结构。HLA基因位于第 6 号染色体,主要有三个 I 类基因( HLA-A、HLA-B 和 HLA-C);三个II 类区域包括 (HLA-DR、HLA-DP 和 HLA-DQ)。(Janeway's Immunobiology, 9th version)
三、从分子机制看:精英控制者的免疫系统有什么不一样?
精英控制者之所以能“压制” HIV,是多层次免疫机制协同的结果,其中 HLA–T 细胞轴是中心环节。
1. CD8+ T 细胞:真正的“主力军”
大量研究表明,精英控制者体内的 HIV 特异性 CD8+ T 细胞具备非同寻常的杀伤能力:在体外实验中,这些 CD8+ T 细胞可以将感染 CD4+ T 细胞中的病毒复制降低 60–80%;即使目标 CD4+ T 细胞处于“静默感染”状态(病毒潜伏不高表达),精英控制者的 CD8+ T 细胞仍有能力识别并清除这些细胞;其 TCR 库更加聚焦于“保护性表位”,对这些关键肽-HLA 的识别门槛更低、反应更快[5]。某种意义上,HLA 负责“选题”,CD8+ T 细胞负责“答题”,精英控制者恰好拥有一套非常优异的“命题+答题系统”。
2. 不一样的病毒“潜伏库”
在普通感染者中,HIV 的完整前病毒常常整合在转录活跃的基因区域,容易被激活再次复制,因此需要长期服药维持抑制。而在精英控制者中,最新研究发现,其体内完整的 HIV 前病毒更倾向于整合到基因沉默或转录抑制区域,处于一种“深度潜伏”的状态,这种特殊的整合位点谱系,很可能是年复一年强大免疫压力“筛选”的结果。换句话说,精英控制者的免疫系统不仅能控制当下的病毒复制,还能塑造一个“安分守己”的“沉睡的”病毒库。[5,6]
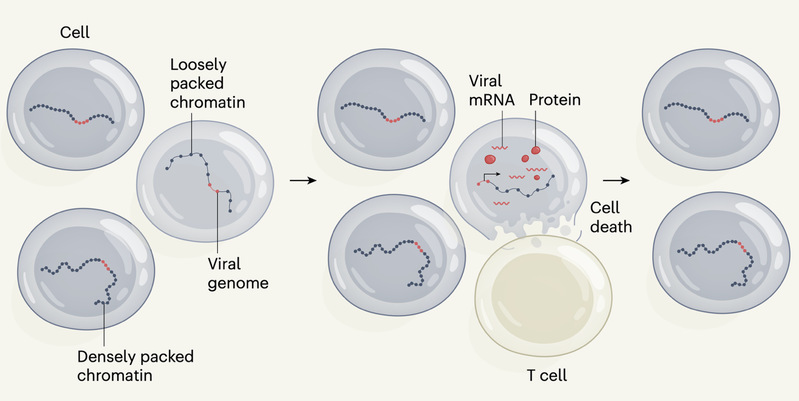
图 2. 精英控制者体内T细胞对“沉睡”的 HIV 的选择过程。在这些精英控制者中,病毒 DNA 可以整合到宿主基因组的各个位置。一些病毒基因组整合在宿主染色质中 DNA 与蛋白质结合较为松散的区域,在这些区域可以发生转录。另一些病毒 DNA 则整合在由于染色质包装致密而转录受到抑制的宿主基因组位点。那些能够转录病毒(产生病毒信使 RNA 和蛋白质)的细胞,会被免疫系统中的 T 细胞高效识别并清除——这一反应只在精英控制者中观察到。随着这些产生病毒的细胞被杀伤,体内就会在进化选择压力下逐渐富集一小群携带深度潜伏 HIV 基因。(N. Chomont,Nature, 2020)
四、为什么要研究“控制者”?——从个体幸运到人类策略
乍看之下,“精英控制者”或“无症状感染者”像是少数人的幸运,和大多数人没什么关系。但在科学和公共卫生的视角下,他们的重要性可能远远超出个体故事。
1. 为 HIV 功能性治愈提供“现成模板”
所谓“功能性治愈”,指的是不必彻底清除体内所有病毒,只要像精英控制者那样,在停药的情况下仍能长期维持极低病毒载量、不发病即可。精英控制者已经在现实中展示了这种状态是可以自然发生的:他们告诉我们,人体免疫系统在理论上是有能力战胜 HIV 的。因此,研究他们的遗传背景、HLA 组合、T 细胞应答特征以及病毒库特点,可以为设计治疗性疫苗、免疫治疗和“后天精英控制者”策略提供非常具体的目标。
2. 为疫苗与免疫策略提供设计蓝图
无论是 HIV 还是新冠,一个很现实的目标不是“零感染”,而是——即使感染了,也像控制者那样“不怕它”。这意味着未来的疫苗设计,可能会更注重:诱导类似精英控制者的高质量 CD8+ T 细胞应答,而不仅仅是中和抗体;针对那些已知由“保护性 HLA”呈递的关键表位进行优化;在某些疾病中,使更多人免疫表型向“无症状或轻症控制者”靠拢。
3. 理解免疫平衡的“最佳区间”
控制者并不是“免疫越强越好”的简单版本。免疫反应太弱,病毒失控;太强或方向错误,又可能引发免疫病或严重炎症(比如新冠重症中的“细胞因子风暴”)。精英控制者和无症状控制者,反映的是一种高度精确、代价较低的免疫平衡:足够强大,能压住病毒;又足够克制,不把机体拖入严重炎症和组织损伤。从这个意义上说,他们为我们理解免疫系统“拿捏分寸”的能力,提供了非常珍贵的人体范本。
五、结语:从“天选之子”到“后天可达”
从科学角度看,HIV 精英控制者、新冠无症状者等各种“疾病控制者”,并不是神话中的“刀枪不入”,而是在特定遗传背景 + 高效能免疫应答共同作用下,达成的一种罕见但真实存在的状态,其中HLA 参与的抗原呈递与免疫调控 起到了“中枢调度”的作用。对普通人来说,我们当然不能指望自己恰好拥有这些“幸运基因”,更不能因为有“控制者”存在,就轻视 HIV 或新冠等疾病的危险性——绝大多数人仍然严重依赖疫苗、药物和公共卫生措施来保护自己。但从人类整体的角度:这些“天选之子”,为我们提供了走向更好预防与治疗策略的地图。科学的目标,就是让越来越多的人,通过疫苗和免疫治疗,在后天成为“可复制的控制者”。或许在不远的将来,当我们谈起 HIV 和其他重大传染病时,可以更加自信地说:不是把病毒完全抹去,而是学会像精英控制者那样,把它们关进“免疫监狱”,永不翻身。
参考文献
[1] Blankson JN. Effector mechanisms in HIV-1 infected elite controllers: highly active immune responses? Antiviral Res. 2010 Jan;85(1):295-302.
[2] Salgado M, Swanson MD, Pohlmeyer CW, Buckheit RW 3rd, Wu J, Archin NM, Williams TM, Margolis DM, Siliciano RF, Garcia JV, Blankson JN. HLA-B*57 elite suppressor and chronic progressor HIV-1 isolates replicate vigorously and cause CD4+ T cell depletion in humanized BLT mice. J Virol. 2014 Mar;88(6):3340-52.
[3] Pereyra F, Jia X, McLaren PJ, Telenti A, Bakker PI, Walker BD, et al. The major genetic determinants of HIV-1 control affect HLA class I peptide presentation. Science. 2010 Dec 10;330(6010):1551-7.
[4] Gaiha GD, Rossin EJ, Urbach J, Landeros C, Collins DR, Nwonu C, Muzhingi I, Anahtar MN, Waring OM, Piechocka-Trocha A, Waring M, Worrall DP, Ghebremichael MS, Newman RM, Power KA, Allen TM, Chodosh J, Walker BD. Structural topology defines protective CD8+ T cell epitopes in the HIV proteome. Science. 2019 May 3;364(6439):480-484.
[5] Hartana CA, Yu XG. Immunological effector mechanisms in HIV-1 elite controllers. Curr Opin HIV AIDS. 2021 Sep 1;16(5):243-248.
[6] Jiang C, Lian X, Gao C, Sun X, Einkauf KB, Chevalier JM, Chen SMY, Hua S, Rhee B, Chang K, Blackmer JE, Osborn M, Peluso MJ, Hoh R, Somsouk M, Milush J, Bertagnolli LN, Sweet SE, Varriale JA, Burbelo PD, Chun TW, Laird GM, Serrao E, Engelman AN, Carrington M, Siliciano RF, Siliciano JM, Deeks SG, Walker BD, Lichterfeld M, Yu XG. Distinct viral reservoirs in individuals with spontaneous control of HIV-1. Nature. 2020 Sep;585(7824):261-267.
